Experimento De Crioscopia. Propriedade Coligativa Da Crioscopia: mergulhe nesse universo fascinante da química física! Vamos explorar como o abaixamento do ponto de congelamento de um solvente, ao adicionar um soluto, revela propriedades intrínsecas das substâncias. Desvendaremos a relação entre a concentração do soluto e a variação da temperatura de congelamento, compreendendo a crioscopia como uma propriedade coligativa – ou seja, uma propriedade que depende apenas do número de partículas de soluto, e não de sua identidade.
Preparado para desvendar os mistérios da crioscopia?
A crioscopia é uma ferramenta poderosa com aplicações práticas em diversas áreas, desde a determinação da massa molar de compostos desconhecidos até a análise da pureza de substâncias. Através de experimentos controlados, podemos quantificar o abaixamento crioscópico e, a partir daí, extrair informações valiosas sobre as propriedades do soluto e do solvente. Veremos como fatores como a pureza do solvente e o tipo de soluto (eletrólito ou não-eletrólito) influenciam diretamente nos resultados obtidos, exigindo atenção aos detalhes e controle rigoroso das variáveis experimentais.
Aplicações Práticas do Experimento de Crioscopia
A crioscopia, estudo do abaixamento do ponto de congelamento de um solvente pela adição de um soluto, possui diversas aplicações práticas em diferentes campos da ciência e da indústria. Sua utilidade reside na capacidade de determinar propriedades importantes de substâncias, como a massa molar, crucial para a identificação e caracterização de compostos desconhecidos. A precisão desta técnica a torna uma ferramenta valiosa em diversas áreas.
Determinação da Massa Molar de Compostos Desconhecidos, Experimento De Crioscopia. Propriedade Coligativa Da Crioscopia
A crioscopia é uma técnica eficaz para determinar a massa molar de compostos desconhecidos. A relação entre o abaixamento do ponto de congelamento (ΔTc) e a molalidade (m) do soluto é descrita pela equação crioscópica: ΔTc = Kc
- m
- i, onde Kc é a constante crioscópica do solvente e i é o fator de van’t Hoff (que considera a dissociação iônica do soluto). Medindo-se o abaixamento do ponto de congelamento de um solvente após a adição de uma massa conhecida de soluto, é possível calcular a molalidade e, consequentemente, a massa molar do soluto. Esta técnica é particularmente útil para compostos orgânicos que não são facilmente volatilizados, tornando técnicas como a espectroscopia de massas menos viáveis.
Exemplos de Aplicações em Diferentes Áreas
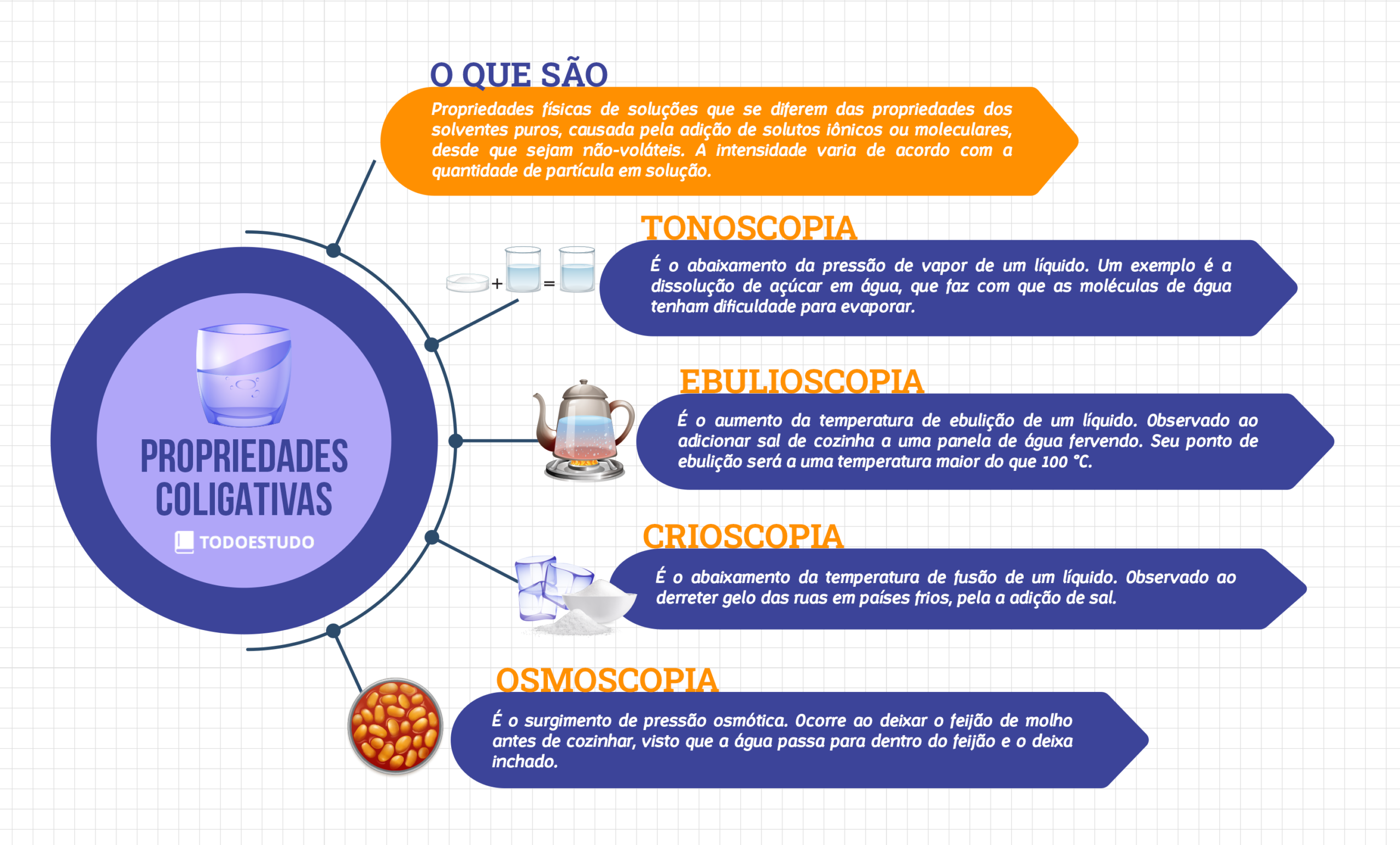
A crioscopia encontra aplicações em diversas áreas. Na química orgânica, a determinação da massa molar de compostos recém-sintetizados é crucial para sua caracterização. Na indústria alimentícia, a crioscopia é utilizada para determinar a pureza de soluções, como o controle de qualidade de sorvetes, onde a presença de impurezas pode afetar o ponto de congelamento. Na bioquímica, a técnica pode auxiliar na determinação da massa molar de proteínas e outras macromoléculas.
A crioscopia também é utilizada em estudos de soluções eletrolíticas, permitindo a determinação do grau de dissociação iônica.
Procedimento Experimental para Determinação da Massa Molar
Para determinar a massa molar de um soluto usando crioscopia, o procedimento experimental envolve as seguintes etapas:
- Preparar uma solução de concentração conhecida do soluto em um solvente com constante crioscópica conhecida.
- Determinar o ponto de congelamento do solvente puro utilizando um crioscópio.
- Determinar o ponto de congelamento da solução preparada.
- Calcular o abaixamento do ponto de congelamento (ΔTc) subtraindo o ponto de congelamento da solução do ponto de congelamento do solvente puro.
- Calcular a molalidade (m) da solução utilizando a equação crioscópica: m = ΔTc / (Kc
– i). - Calcular a massa molar do soluto utilizando a definição de molalidade: m = (massa do soluto / massa molar do soluto) / (massa do solvente em kg).
Roteiro para um Experimento de Crioscopia
Materiais: Balança analítica, béqueres, termômetro de precisão (com precisão de pelo menos 0.1°C), banho de gelo, agitador magnético com barra magnética, crioscópio (opcional, mas recomendado para maior precisão).Reagentes: Solvente (ex: água destilada, benzeno, cicloexano), soluto de massa molar desconhecida (a escolha do solvente deve ser feita de acordo com a solubilidade do soluto).Procedimentos: Seguir as etapas descritas na seção anterior, garantindo a precisão nas medições de massa e temperatura.
A utilização de um crioscópio garante maior precisão na determinação dos pontos de congelamento. É importante realizar várias medições para minimizar erros experimentais e calcular a média dos resultados.
Dados Obtidos em um Experimento de Crioscopia
A tabela abaixo apresenta dados hipotéticos obtidos em um experimento de crioscopia para determinar a massa molar de um soluto desconhecido em água (Kc = 1,86 °C/m). Assumimos i=1 para simplificação.
| Massa do soluto (g) | Massa da água (g) | Temperatura de congelamento da solução (°C) | Massa molar calculada (g/mol) |
|---|---|---|---|
| 1,00 | 100,00 | -0,186 | 186 |
| 2,00 | 100,00 | -0,372 | 186 |
| 3,00 | 100,00 | -0,558 | 186 |
Fatores que Influenciam o Experimento de Crioscopia: Experimento De Crioscopia. Propriedade Coligativa Da Crioscopia
A determinação experimental do abaixamento crioscópico, apesar de conceitualmente simples, é suscetível a diversos fatores que podem comprometer a precisão dos resultados. Compreender esses fatores é crucial para a obtenção de dados confiáveis e para a interpretação correta dos resultados obtidos. A seguir, serão discutidos alguns dos principais fatores que influenciam a precisão do experimento.
Pureza do Solvente

A pureza do solvente utilizado é um fator crítico na determinação precisa do abaixamento crioscópico. A presença de impurezas no solvente afeta diretamente a constante crioscópica (Kc) e, consequentemente, o cálculo da massa molar do soluto. Impurezas atuam como solutos adicionais, causando um abaixamento crioscópico maior do que o esperado para o solvente puro. Quanto maior a concentração de impurezas, maior será o erro na determinação do abaixamento crioscópico.
Para minimizar esse erro, é essencial utilizar solventes de alta pureza, preferencialmente grau reagente. A utilização de solventes previamente purificados por destilação ou outros métodos apropriados garante maior precisão.
Comportamento de Diferentes Tipos de Solutos
Solutos não-eletrólitos, como a sacarose, dissolvem-se em solução sem se dissociar em íons. Seu abaixamento crioscópico segue diretamente a lei de Raoult, onde a depressão do ponto de congelamento é proporcional à molalidade do soluto. Já os eletrólitos, como o cloreto de sódio (NaCl), dissociam-se em íons em solução (NaCl → Na⁺ + Cl⁻). Essa dissociação aumenta o número de partículas em solução, levando a um abaixamento crioscópico maior do que o previsto para um não-eletrólito de mesma molalidade.
O fator de van’t Hoff (i) corrige esse efeito, representando o número efetivo de partículas em solução. Para o NaCl, o fator i ideal seria 2, mas em soluções concentradas, interações iônicas podem diminuir esse valor.
Dissociação Iônica e Abaixamento Crioscópico
A dissociação iônica de um eletrólito influencia diretamente o abaixamento crioscópico. Um eletrólito que se dissocia completamente em solução terá um abaixamento crioscópico maior do que um eletrólito que se dissocia parcialmente. Por exemplo, o NaCl (dissociação completa) apresentará um abaixamento crioscópico maior que um ácido carboxílico fraco (dissociação parcial) na mesma molalidade. Essa diferença é quantificada pelo fator de van’t Hoff (i), que considera o grau de dissociação do eletrólito.
A fórmula para o abaixamento crioscópico, considerando a dissociação iônica, é:
ΔTc = i
- K c
- m
onde ΔT c é o abaixamento crioscópico, i é o fator de van’t Hoff, K c é a constante crioscópica do solvente e m é a molalidade do soluto.
Quantificação de Impurezas em Solventes por Crioscopia
A crioscopia pode ser utilizada para quantificar a presença de impurezas em um solvente. Medindo o abaixamento crioscópico de um solvente impuro em relação ao solvente puro, podemos determinar a concentração de impurezas. Por exemplo, se medirmos o ponto de congelamento de uma amostra de água e observarmos um abaixamento em relação ao ponto de congelamento da água pura (0°C), podemos calcular a molalidade das impurezas presentes na água, assumindo que as impurezas se comportam como não-eletrólitos.
Considerando a constante crioscópica da água (K c = 1,86 °C/m), se observarmos um abaixamento de 0,372 °C, a molalidade das impurezas será:
m = ΔTc / K c = 0,372 °C / 1,86 °C/m = 0,2 m
Isso indica a presença de 0,2 mols de impurezas por quilograma de água. É importante ressaltar que este cálculo assume que as impurezas são não-eletrólitos e que não há interações significativas entre as impurezas e a água.
Em resumo, o experimento de crioscopia nos proporciona uma compreensão profunda das propriedades coligativas e sua relação com a estrutura molecular das substâncias. A capacidade de determinar massas molares e avaliar a pureza de compostos, através da simples medição do abaixamento do ponto de congelamento, demonstra a elegância e a utilidade dessa técnica. A análise dos fatores que influenciam a precisão do experimento ressalta a importância do rigor científico e do controle das variáveis para a obtenção de resultados confiáveis.
Compreender a crioscopia abre portas para um vasto campo de aplicações em química, bioquímica e engenharia, consolidando seu papel como uma técnica fundamental na análise de soluções.

